严守质量生命线 共筑科研新高地
为进一步推动我院临床试验标准化规范化建设,2月21日,首都医科大学附属北京儿童医院临床研究中心质控专家组一行6人对我院儿科承接的一项《在1至<5岁中国儿童流感患者中评估玛巴洛沙韦的安全性、有效性的单臂、多中心临床试验》开展全方位“把脉问诊”。北京儿童医院顺义妇儿医院副院长、临床试验机构副主任陈晖,科研教育科、伦理办公室主任柳亚芬,机构办公室主任张晓芬、机构办秘书冯德明、伦理办秘书张毅、项目质控员丁新及该项目监查员(CRA)、临床研究协调员(CRC)共同迎接。


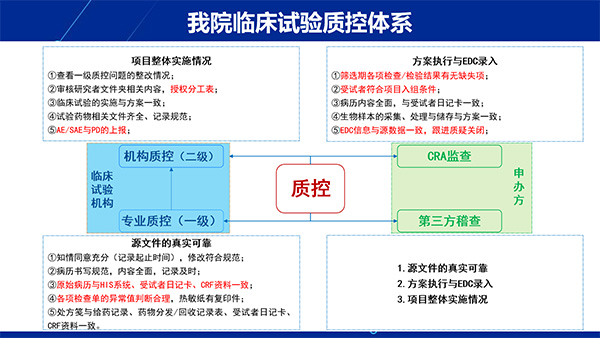
此次质控检查,专家组聚焦临床试验“全流程、全要素、全维度”质量管控,通过“查问题、补短板”的闭环管理,全面检验我院临床试验质量管理体系的科学性及严谨性。以《药物临床试验质量管理规范(2020版)》(简称2020版GCP)为基准,从方案设计到数据封存进行全流程质控,并对以下关键环节进行了穿透式检查,包括:试验方案合规性;知情同意规范性;试验用药品管理;生物样本的管理;试验数据真实性;安全性监测报告等各个方面。从一份知情同意书的签署到一项全国多中心试验的完成,每个细节都关乎科学尊严与患者生命。高质量的临床试验能够有效保障受试者的安全和权益,确保试验数据的真实性、完整性和可溯源性,从而为药物或医疗器械的安全性及有效性评价提供可靠依据。因此,严格遵循GCP要求,建立完善的质量管理体系,实施全过程风险管控,既是履行研究者职责、维护受试者福祉的必然要求,也是推动医药创新成果经得起科学验证和监管审查的重要基石。机构办公室基于临床试验法律法规要求并结合我院实际特建立我院临床试验质控体系,该体系由临床试验机构及申办方(CRO公司)共同保障实施。
此次联合检查既是“显微镜”也是“推进器”,我院将以此次检查为契机,持续强化“质量源于设计、质量源于执行”的理念,为打造具有竞争力的临床试验机构保驾护航。
相关知识链接
玛巴洛沙韦是一种小分子新型CAP依赖性核酸内切酶抑制剂,可阻断病毒复制所需的流感病毒mRNA转录,单次口服给药可有效预防及治疗甲型或乙型流感病毒感染。2021年,该药片剂在国内上市。2023年12月该药干混悬剂获批上市,为吞咽片剂困难患儿及低龄儿童提供更适宜的剂型选择。在我国,目前其适应症仍局限于5岁及以上儿童和成人流感治疗;在欧盟、瑞士、韩国,玛巴洛沙韦已获批用于1岁以上儿童的治疗和暴露后预防;在日本,获批用于10公斤以上人群的治疗和20公斤以上人群的暴露后预防。当前,亟需补充其在中国低龄儿童应用的安全性数据。
该临床试验为国内多中心研究,牵头单位为首都医科大学附属北京儿童医院,参研中心包括南京市儿童医院、北京儿童医院顺义妇儿医院、温州医科大学附属第二医院、首都儿科研究所附属儿童医院、河南省儿童医院郑州儿童医院、济南市儿童医院、浙江大学医学院附属儿童医院、首都医科大学附属北京儿童医院保定医院、华中科技大学同济医学院附属同济医院等10家中心。拟在全国招募100例受试者,各参研中心竞争入组。2024年11月,该临床试验在我院通过临床试验机构办公室立项审查、伦理委员会伦理审查,正式获批立项;2024年12月6日召开项目启动会,2025年1月26日,完成全国入组,我中心共入组13例受试者,目前均已顺利出组。
下一篇: 春季护肤指南:科学应对干燥与敏感




























